12 месяцев. Несовершенный остеогенез. Часть первая: хрустальное царство
Информационно-просветительский гуманитарный проект «12 месяцев» — это цикл материалов о необычных людях – пациентах с редкими (орфанными) болезнями, о которых не написано в студенческих учебниках. Считается, что вероятность встретить на профессиональном пути редкого пациента у обычного врача ничтожно мала, поэтому в академических аудиториях им не уделяют должного внимания, что в повседневной жизни приводит к диагностическим ошибкам, упущенному времени и поломанными судьбами и жизням. Проект «12 месяцев» реализуют студенты и ординаторы – будущие и нынешние специалисты, активно изучающие генетические методы диагностики, их место в современной врачебной работе. Материалы готовятся на кафедре патологической анатомии СЗГМУ им. И.И. Мечникова (Санкт-Петербург) при поддержке научно-практического журнала «Гены и Клетки», группы компаний ИСКЧ, блога истории медицины и порталов Indicator.Ru и «Нейроновости». Каждая часть проекта состоит из двух или трех материалов: рассказа о заболевании (чаще всего с видеотаймлайном его изучения), и пациентской истории. Научные редакторы проекта — Алексей Паевский и Роман Деев. Новый цикл статей посвящен несовершенному остеогенезу.

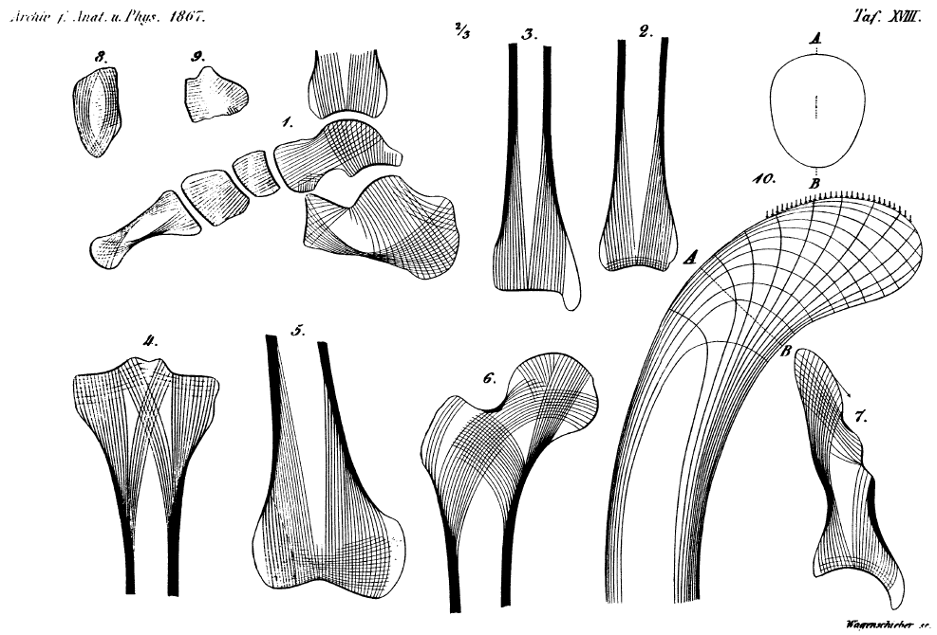
Какая самая прочная на разрыв ткань человеческого тела? На первом месте окажутся ткани зуба, связки и сухожилия, но куда интереснее секрет крепости костей. Ученые утверждают, что кости превосходят в прочности даже сталь, хотя и гораздо легче неё. Секрет механической надежности кости был раскрыт швейцарским профессором анатомии Джорджем Херманом Фон Мейером в середине XIX века. Его тревожило любопытство: как, например, бедренная кость способна выдерживать вес практически всего человеческого тела, имея при этом изгиб в области, формирующей тазобедренный сустав.
Фон Мейер открыл удивительно строгую геометрическую структуру костных балок, равномерно перераспределяющих нагрузку на всю кость. Чуть позже швейцарские ученые-инженеры адаптировали это свойство для конструирования строительных объектов, что, спустя еще 30 лет, помогло Густаву Эйфелю возвести свою знаменитую на весь мир башню.

Люди были убеждены в превосходной крепости костей на протяжении всей истории, пока в конце семнадцатого века шведский врач Олаф Экман не привел доказательств состояния, противоположного прочности, — хрупкости. Он рассказал историю семьи, которая в течение трех поколений была известна как «раса карликов», со своеобразным телосложением и хрупкостью костей, что приводило к искажениям туловища и конечностей (1). Спустя пару десятилетий французский патолог Дж. Ф. Лобштейн отметил схожее заболевание у трех детей одной семьи, назвав это идиопатическим остеопсатирозом (прим. 1).
В середине XIX века голландский патолог Виллем Вролик описал младенца с укороченными и деформированными конечностями, умершего через 3 дня после рождения. Он отметил плохо развитый скелет, короткое и узкое лицо, а лобная, теменная и затылочная кости были cломаны. Все представленные кости скелета имела множественные переломы. В своих текстах В. Вролик использовал в заголовке термин «Несовершенный остеогенез» (2). Позже оказалось, что В. Вролик и Дж. Лобштейн описывали одно заболевание.
Собственно, несовершенный остеогенез (НО) – группа редких наследственных заболеваний соединительной ткани, основным симптомом которых является хрупкость костей, вызывающая их переломы и деформацию (3). Частота встречаемости НО составляет 1:10 000 новорожденных, а это значит, что в нашей стране таких пациентов целое царство – около 15 000 человек.
В 2009 году на совещании Международной группы по номенклатуре конституциональных расстройств скелета (International Congress of Human Genetics, ICHG) была предложена следующая классификация [4]:
— НО I типа: легкая форма, недеформирующий НО с повышенной хрупкостью и голубыми склерами;
— НО II типа: летальный исход в первую неделю после рождения;
— НО III типа: «прогрессивно деформирующий»;
— НО IV типа: умеренная форма;
— НО V типа: НО с кальцификацией костей.
Самыми распространенными причинами НО являются мутации в более чем 10 генах, ответственных за синтез коллаген I типа, преимущественно содержащегося в костях. Коллаген — специальный белок, составляющий основу соединительной ткани организма. Простыми словами коллаген — это ниточка (нитка, веревка, …канат!), состоящая из трех аминокислотных цепей, две из которых называются α1 и одна α2. Следует уточнить, что в этой последовательности аминокислот каждое третье положение занимает аминокислота глицин. Сами по себе ниточки тонкие и непрочные, но весь секрет в том, что они заплетаются в спиралевидные канатики, которые между собой собираются в более объемные канаты, фибриллы (прим 2), которые формируют очень прочные волокна. Они же в составе соединительной ткани выполняют роль внутреннего каркаса костей. Рост и формирование простой ниточки проходит в несколько этапов и требует слаженной работы многих регуляторов её сборки.Мутации в одном из двух генов, кодирующих цепи коллагена, которые именуются COL1A1 и COL1A2, считаются ответственными за 90% случаев НО. Как оказалось недавно некоторые формы НО связаны с мутациями в других генах, что позволило выделить отдельную группу – т.н. неколлагеновых НО.
Причина проявлений большей части состояний, описываемых как несовершенный остеогенез заключается в разного рода дефектах генов коллагена: структурных и количественных. Самым распространенным структурным нарушением является замена глицина в случайном месте любой из трех аминокислотных цепей, что приводит к нарушению спиралевидной конструкции волокна. Нормальные фибриллы являются своеобразными «направителями», указателями для остеобластов — клеток, за счёт которых развивается костная ткань – минерализованный матрикс. Благодаря правильному указанию пути оссификации (прим. 3) развивается строгая геометрическая конструкция минерализующих волокно кристаллов гидроксиапатита, придающая костям прочность. В случае заболевания измененные фибриллы направляют процесс роста кристаллов фосфата кальция «не по чертежам», что приводит к развитию рыхлого, неправильно структурированного остова кости, который бы явно не вдохновил Гюстава Эйфеля на постройку башни.
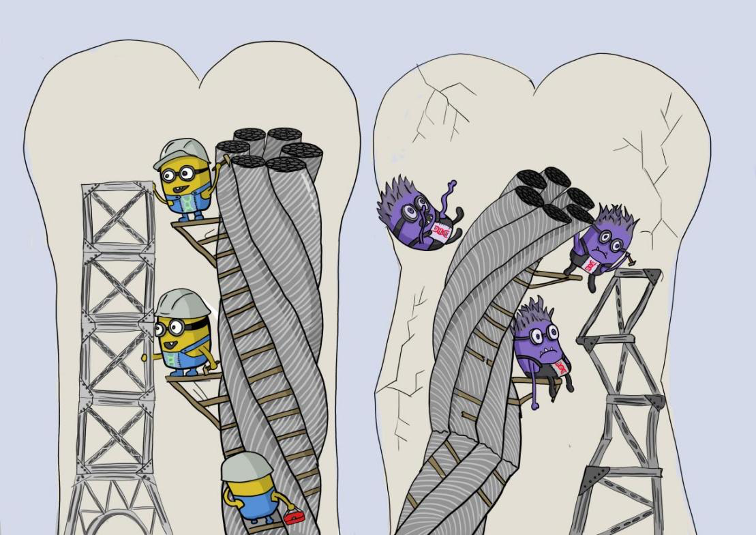
Вторым механизмом развития хрупкости является повышенная активность остеокластов — клеток, ответственных за разрушение костного матрикса, которое в норме сбалансировано с её синтезом. Считается, что при НО количество остеокластов повышается в ответ на деформированный коллаген, что обуславливает повышенное разрушение кости и еще большее снижение прочности. Количественный дефект коллагена, а именно его недостаток, приводит к неполной минерализации, ведущей к истончению кости — причине их хрупкости.
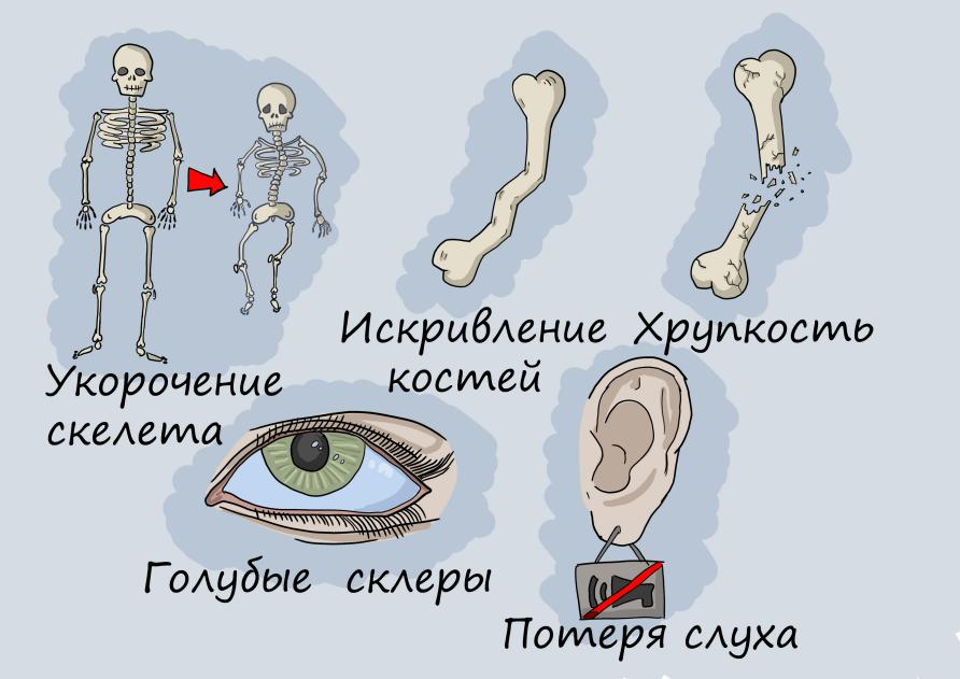
Клинические проявления несовершенного остеогенеза начинаются в детстве: с начала ходьбы возникают первые переломы, а по мере роста ребенка отмечаются искривления костей: бедренной, большеберцовой, лучевой, локтевой, костей грудной клетки и черепа. Из-за дефектов коллагена, находящегося в составе белочной оболочки глаза — склеры, сквозь нее просвечивает глубжележащий пигмент меланин, придавая ей голубой цвет. Деформации косточек в среднем ухе часто приводят к потере слуха; неправильное формирование зубов (да-да, в их основе тоже лежит коллагеновый каркас) приводит к их обесцвечиванию и полупрозрачности. Элементы скелета становятся хрупкими и как будто полупрозрачными, поэтому за такими людьми повелось прозвище «хрустальные дети».
Установить диагноз несовершенного остеогенеза позволяет молекулярно-генетическое исследование на наличие мутаций в генах COL1A1 и COL1A2. Заподозрить заболевание можно по вышеописанным клиническим проявлениям. С высокой степенью уверенности диагноз может быть установлен при наличии характерных рентгенологических признаков (5):
генерализованный остеопороз (прим 4), в который вовлечеы и позвонки, и ребра, и кости конечностей; укорочение и истончение длинных костей конечностей с множественными переломами; дугообразные конечности; истонченные ребра; сдавление позвонков, ведущее к уменьшению роста (6).
С помощью денситометрии (прим. 5) можно измерить минеральную плотность костей, которая при НО будет снижена. Заподозрить болезнь еще внутриутробно позволяет УЗИ; этим способом можно найти укорочение длины бедренной кости – уже во втором триместре, угловатость или искривление длинных костей и неправильный изгиб ребер [7, 8]. В случае, когда в семье уже известны случаи НО в старших поколениях, ей предлагается медико-генетическое консультирование, дающее представление о будущем.
Лечение НО – к сожалению, пока только симптоматическое и подбирается индивидуально для каждого пациента в зависимости от его возраста, типа и тяжести НО (9). Клиническими целями такого лечения будут:снижение частоты переломов, облегчение боли и стимулирование роста костей, увеличение возможностей подвижности и обретения независимости от посторонней помощи, то есть – повышение качества жизни (10). Эта цель может быть достигнута путем воздействия на два компонента метаболизма кости: стимулирование роста (остеогенез) и блокирвоание разрушения остеокластами.
В настоящее время бисфосфонаты — основа патогенетической терапии. Эти препараты оказывают действие через подавление активности остеокластов и индукцию их самоуничтожения (11). Согласно исследованиям, бисфосфонаты бесспорно увеличивают минеральную плотность кости (12). Однако показатель сокращения частоты переломов в множестве исследований противоречив (13, 14). Вместе с тем, следует учесть, что блокировка работы остеокластов не ведет к нормализации качества костной ткани (качества коллагена), а лишь снижает скорость ее разрушения, что может приводить к увеличению ее объема, косвенно влияющего на повышение прочности.
Совместно с терапией бисфосфонатами применяют хирургическое лечение переломов, у которого есть свои особенности: чем дольше длится период обездвиживания конечности, тем сильнее прогрессирует хрупкость, в результате чего формируется замкнутый круг: перелом – иммобилизация – перелом. Хирургическое лечение несовершенного остеогенеза включает операции на конечностях и позвоночном столбе с использованием остеотомии (хирургическая процедура, при которой кость разрезается для ее выпрямления) и придания им правильной анатомической формы с помощью металлоконструкций.
Сегодня клинические испытания терапии НО проходят многие препараты, доказавшие свою эффективность в лечении остеопороза. Однако, не будем забывать, что речь идет о симптоматической и лишь от части патогенетической терапии не искореняющей первопричину болезни – повреждение гена.
Весьма заманчивым показалась возможность подселить в кости остеобласты – клетки строители, от здорового донора. По мысли разработчиков такой технологии, колонизировав кости пациента, они начнут синтезировать полноценный коллаген, постепенно, шаг за шагом, год за голом он вытеснит коллаген порочный и прочность кости станет неотличимой от нормы. Такая клеточная терапия НО начала развиваться два десятилетия назад. Внутриутробное введение в пупочную вену плода донорских мезенхимальных стволовых клеток – очень молодых остеобластов, технически впооне выполнимо (2005, 2014, 15-19). Введение этих же клеток в детском возрасте возобновляет остановленный при заболевании рост. В некоторых случаях полученные положительные результаты заключались в снижении числа переломов и ускорении роста, но, к сожалению, такой достигнутый результат лишь временный. Донорские клетки отказываютя жить в чужом доме, приживаются в костной ткани реципиентов лишь 1,5-2% из них. Как бы активно они не работали после этого, их синтетическая активность не может повляиеть на качество костной ткани всего скелета.
Единственным вариантом этиотропного – направленного на первопричину, лечения является генная терапия. Мутация в ДНК, главном чертеже, ведет к неправильному «срисовыванию» РНК — ошибочному чертежу. По нему строятся аномальные молекулы коллагена — белки. Они уже не могут уложится в геометрическую структуру, обеспечивающую прочность всей конструкции. Одна из технологических идей генной терапии заключается в том, чтобы сначала перечеркнуть и стереть все неправильные чертежи — заблокировать молекулы РНК (это необходимо, чтобы остановить синтез неправильного коллагена, значительная часть НО – аутосомно-доминантное заболевание). Далее можно взять остеобласты больного и переучиваем их — исправляем мутацию в лабораторных условиях. После этого их можно возвращать домой. Данные по такому лечению у мышей оказались обнадеживающими, но прошло уже два деятилетия с момента их получения, а воз и ныне там (20). Сегодня все еще нет зарегистрированных клинических исследований по проверке безопасности и эффективности генной терапии НО (21).

В России благодаря усилиям неравнодушных к проблеме несовершенного остеогенеза людей существует фонд, оказывающий помощь в получении медикаментозной терапии и хирургического лечения, а также психологической и социальной поддержки, осуществляющий реализацию реабилитации — фонд “Хрупкие люди” — https://hrupkie.ru. Кроме того, фонд предоставляет множество материалов по правилам ухода за больными детьми, также обучающие лекции и полезные статьи.
Отдельно помощь детям с НОГ осуществляет «Русфонд.Перелом» https://rusfond.ru/list-intro/21.
Текст: Василий Горбачев, Евгений Пресняков, Роман Деев.
Примечания:
(1) Остеопсатироз — от греческого osteon-—кость и psathyrosis—ломкий.
(2) Фибриллы — тонкие волоконца, расположенные в межклеточном веществе.
(3) Оссификация (окостенение, развитие костей) — процесс формирования костной ткани; научный синоним — остеогенез.
(4) Остеопороз – полиэтиологический синдром, связанный с нарушением обмена веществ, проявляющийся прогрессирующим снижением количества минерала кости, ее плотности и нарушением структуры.
(5) Денситометрия — способ оценки минеральной плотности костной ткани, выполняемый рентгенологическими методами
Литература:
Ekman O.J. Descriptionem et caws aliquot osteomalaciae sistens. Dissertatio Medica Upsaliae, 1788. Baljet B. Aspects of the history of osteogenesis imperfecta (Vrolik’s syndrome). Annals of anatomy = Anatomischer Anzeiger: official organ of the Anatomische Gesellschaft. 2002; 184(1): 1–7. Lindahl K., Åström E., Rubin C. et al. Genetic epidemiology, prevalence, and genotype-phenotype correlations in the Swedish population with osteogenesis imperfecta. Eur. J. Hum. Gen. 2015; 23(8): 1042–1050. Van Dijk F.S., Sillence D.O. Osteogenesis imperfecta: clinical diagnosis, nomenclature and severity assessment. Am. J. Med. Gen. 2014; Part A, 164A(6); 1470–1481. https://emedicine.medscape.com/article/947588-overview Calder A.D. Radiology of Osteogenesis Imperfecta, Rickets and Other Bony Fragility States. Endocrine Dev. 2015; 28: 56–71. Milks K.S., Hill L.M., Hosseinzadeh K. Evaluating skeletal dysplasias on prenatal ultrasound: an emphasis on predicting lethality. Ped. Rad. 2017; 47(2): 134–145. Krakow D. Osteogenesis Imperfecta. Skeletal Dysplasias: An Overview. 2018: 270-273. Marom R., Rabenhorst B.M., Morello R. Osteogenesis imperfecta: an update on clinical features and therapies. Eur. J. End. 2020; 183(4): R95–R106. Rossi V., Lee B., Marom R. Osteogenesis imperfecta: advancements in genetics and treatment. Current opinion in Ped. 2019; 31(6): 708–715. Morello R. Osteogenesis imperfecta and therapeutics. Matrix biology. J. Int. Soc. Mat. Biol. 2018; 71-72: 294–312. Bains J.S., Carter E.M., Citron K.P. et al. A Multicenter Observational Cohort Study to Evaluate the Effects of Bisphosphonate Exposure on Bone Mineral Density and Other Health Outcomes in Osteogenesis Imperfecta. JBMR. 2019; 3(5): e10118. Dwan K., Phillipi C.A., Steiner R.D., Basel D. Bisphosphonate therapy for osteogenesis imperfecta. The Cochrane database of systematic reviews. 2016; 7: CD005088. Яхяева Г.Т. Научное обоснование новых подходов к диагностике и лечению несовершенного остеогенеза у детей [диссертация] Москва: «Научный центр здоровья детей»; 2016. Le Blanc K., Götherström C., Ringden O. et al. Fetal mesenchymal stem-cell engraftment in bone after in utero transplantation in a patient with severe osteogenesis imperfecta. Transplan. 2005; 79(11): 1607–1614. Götherström C., Westgren M., Shaw S.W. et al. Pre- and postnatal transplantation of fetal mesenchymal stem cells in osteogenesis imperfecta: a two-center experience. Stem Cells Transl. Med. 2014; 3(2): 255–264. Сергеев В.С., Тихоненко Т.И., Буклаев Д.С. и др. Клеточная терапия несовершенного остеогенеза. Гены и Клетки. 2016; 11(4): 22-33. Horwitz E.M., Prockop D.J., Fitzpatrick L.A. et al. Transplantability and therapeutic effects of bone marrow-derived mesenchymal cells in children with osteogenesis imperfecta. Nature Med. 1999; 5(3): 309–313. Horwitz E.M., Prockop D.J., Gordon P.L. et al. Clinical responses to bone marrow transplantation in children with severe osteogenesis imperfecta. Blood. 2001; 97(5): 1227–1231. Niyibizi C., Wang S., Mi Z., Robbins P.D. (2004). Gene therapy approaches for osteogenesis imperfecta. Gene Ther. 2004; 11(4): 408–416. Schindeler A., Lee L.R., O`Donohue A.K. et al. Curative Cell and Gene Therapy for Osteogenesis Imperfecta. J. Bone Mine.r Res. 2022; 37(5): 826–836.