«12 месяцев». Муковисцидоз. Часть первая: вязкое проклятие
Информационно-просветительский гуманитарный проект «12 месяцев» — это цикл материалов о необычных людях – пациентах с редкими (орфанными) болезнями, о которых не написано в студенческих учебниках. Считается, что вероятность встретить на профессиональном пути редкого пациента у обычного врача ничтожно мала, поэтому в академических аудиториях им не уделяют должного внимания, что в повседневной жизни приводит к диагностическим ошибкам, упущенному времени и поломанными судьбами и жизням. Проект «12 месяцев» реализуют студенты и ординаторы – будущие и нынешние специалисты, активно изучающие генетические методы диагностики, их место в современной врачебной работе. Материалы готовятся на кафедре патологической анатомии СЗГМУ им. И.И. Мечникова (Санкт-Петербург) при поддержке научно-практического журнала «Гены и Клетки», блога истории медицины и порталов Indicator.Ru и «Нейроновости». Каждый проект будет состоять из трех материалов: рассказа о заболевании с видеотаймлайном его изучения, и пациентской истории. Научные редакторы проекта — Алексей Паевский и Роман Деев. Пятый цикл статей посвящен муковисцидозу.
Муковисцидоз – заболевание, которое преследует человечество издревле. Оно окутано преданиями о ведьмах и проклятиях, а самые ранние упоминания найдены в рукописях исследователей средних веков. Что таит в себе история одной болезни, столь незаметной для одних и столь смертельной для других? Как её смогли распознать, исследовать и к какому результату пришли на сегодняшний день? Об этом мы расскажем вам в нашем небольшом видео.
Если вам стало интересно, давайте попробуем более детально ответить на вопрос, что же такое муковисцидоз?
Муковисцидоз или кистозный фиброз– тяжёлое наследственное заболевание, при котором повышенная вязкость выделяемой слизи критически нарушает работу органов дыхания и пищеварения, приводя к развитию опасных для жизни состояний – истощения, кишечной непроходимости, пневмонии, сепсиса, почечной и дыхательной недостаточности. При этом заболевании также часто бывают нарушены функции печени и сердца, а у мужчин – еще и бесплодие. Заболевание развивается из-за мутации – структурного изменения гена CFTR. В России число людей с диагнозом “кистозный фиброз” на 2018 год составило 3142 человека, а по данным массового обследования новорожденных, из 10 тысяч рождённых детей один обычно болен муковисцидозом. Во всем мире сегодня от этого заболевания страдают около 100 000 человек.
Структурные изменения гена или мутации, представляют собой изменения молекулы ДНК, по "инструкции" которой строятся белки – главная рабочая сила клетки. Изменения молекулы ДНК выражаются в смене последовательности её составных частей (азотистых оснований): аденина (A), тимина (T), цитозина (C), гуанина (G). Изменение такого “буквенного” кода способно прекратить выработку белка, нарушить его перемещение по клетке, встраивание его в место своего функционирования (клетка большая, а место работы должно быть строго определённым!) или ограничить объём выполняемой работы – всё это ведёт к снижению или полному отсутствию функции. В случае муковисцидоза утрачивается или снижается функция переноса из клетки заряженных частиц - ионов хлора (Cl-), через непроницаемую мембрану клетки. Клетки используют перенос ионов для различных целей, одна из них – перемещение молекулы воды в места скопления веществ (осмос). При муковисцидозе, ионы хлора не выходят из клетки и притягивают внутрь неё положительно заряженные ионы натрия (Na+). Это значительно снижает снабжение слизи водой, окружающей ионы. Слизь, вырабатываемая различными видами эпителия нашего организма, становится вязкой и густой, нарушается её выведение. Выявлено уже 352 мутации гена CFTR, способные привести к развитию муковисцидоза; их разделили на 6 функциональных классов (рис. 1).
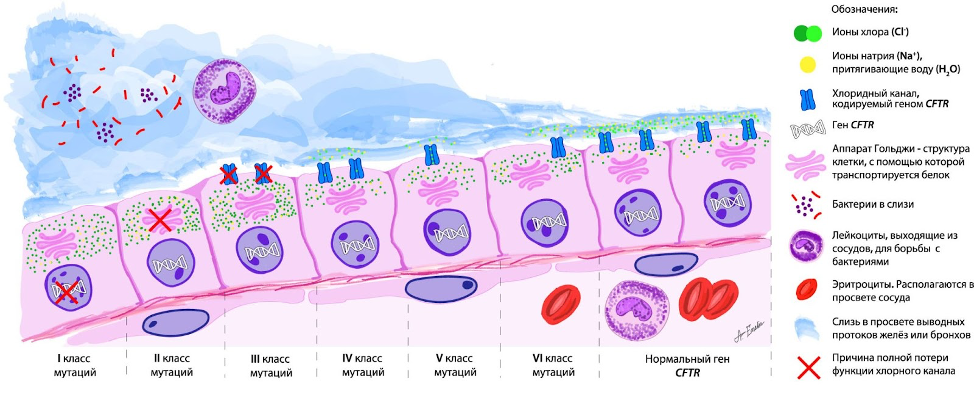
Давайте подробнее разберем эти классы:
● I класс – белок не синтезируется; ● II класс – белок не претерпевает нужной обработки в аппарате Гольджи и не может транспортироваться в место функционирования; ● III класс – белок встраивается в место функционирования, но не выполняет свои функции; ● IV класс – белок работает, но проводит недостаточное количество ионов хлора; ● V класс – белок синтезируется в недостаточных количествах; ● VI класс – белок нестабилен.
I, II и III класс относят к “тяжёлым” мутациям, а IV, V и VI класс мутаций, при которых функция частично сохранена – к “лёгким”.
Такое подразделение условно, поскольку на тяжесть течения заболевания значительно влияет его раннее выявление и приверженность к постоянному, не прекращаемому лечению. Поздняя диагностика, что часто бывает с лёгкими мутациями (в России максимальный возраст, в котором был установлен диагноз муковисцидоз составляет 44 года), или прекращение лечения может привести к необратимым изменениям в организме пациента. Найти к какому функциональному классу относят болезнетворную мутацию можно в Приложении 2 (стр. 64) к “Регистру больных муковисцидозом в Российской Федерации. 2018 год”.
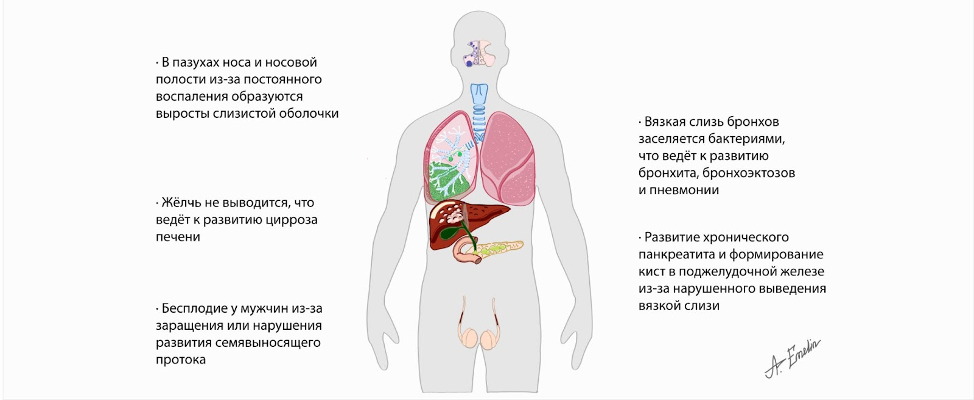
Таким образом, мутации гена CFTR способствуют повреждению поджелудочной железы, лёгких, печени, мужских половых желёз, слизистых оболочек (рис. 2).
Однозначную прямую связь мутации этого гена имеют с поражением поджелудочной железы. В ней есть структуры двух видов: одни вырабатывают ферменты и обеспечивают их выделение в просвет кишечника для переваривания пищи (внешнесекреторная функция), другие вырабатывают гормоны, выделяя их в кровь (внутрисекреторная функция). При муковисцидозе в первую очередь нарушается внешнесекреторная функция. Ферменты необходимые для пищеварения не способны преодолеть выводящие протоки (“трубы”), идущие к кишечнику и выстланные вырабатывающими слизь клетками, т.к. их просвет закрыт вязкой слизью как пробкой. В итоге ферменты активируются внутри поджелудочной железы и переваривают её. Из-за этого развивается хронический панкреатит, заканчивающийся образованием кист (полостей) и фиброза (разрастания плотной нефункциональной соединительной ткани, обычно выполняющей функции каркаса органа). Нарушенное поступление пищеварительных ферментов в кишечник способствует развитию диареи, плохого переваривания, истощению, похуданию, системным нарушениям метаболизма. У пациентов с лёгкими классом мутаций потеря внешнесекреторной функции протекает постепенно, на протяжении нескольких лет, а у обладателей тяжелого класса мутаций нарушения поджелудочной железы выявляются уже внутриутробно. В более позднем возрасте у 20% пациентов развивается инсулин-зависимый сахарный диабет. Собственные железы кишечника, производящие слизь, также могут поражаться при этом заболевании. В совокупности с нарушенным перевариванием пищи, это повышает риск развития кишечной непроходимости.
Поражения лёгких зависят от мутаций гена CFTR, но не столь однозначно, как в случае с поджелудочной железой. Мутации этого гена значительно нарушают внутриутробное развитие лёгких, но в качестве основной причины нарушения дыхания рассматривают колонизацию микроорганизмами вязкой слизи дыхательных путей. На инфекцию организм реагирует воспалением, стимулирующим приход в ткани лёгкого специализированных клеток крови – лейкоцитов. Лейкоциты, и именно нейтрофилы, призваны бороться с микроорганизмами, но выделяемые ими ферменты разрушают каркас лёгких и бронхов, что деформирует ткани лёгкого при пневмонии, ведёт к формированию бронхоэктазов (участки расширения бронхов), снижает площадь поверхности альвеол необходимой для интенсивного насыщения кислородом крови, способствует поддержанию очагов инфекции в организме, развитию пневмонии и сепсиса. Заканчиваются такие разрушительные процессы формированием дыхательной недостаточности – несоответствия количества поглощаемого кислорода потребностям организма.
Помимо мутаций гена CFTR, на тяжесть течения заболевания лёгких у пациентов с муковисцидозом влияют гены-модификаторы. Они представляют собой специфические варианты строения генов с изменённой активностью, способные либо ухудшать течение болезни, как в случае генов MBL, HLA II, TGFβ1 с пониженной активностью (вероятно, за счет ослабления иммунитета), либо улучшать течение, как в случае повышенной активности гена NOS1 (что связывают с антибактериальным эффектом и снижением числа нейтрофилов в зоне воспаления). Нарушение структуры лёгких затрудняет перемещение по ним крови, что перегружает сердце, в конечном итоге повреждая его.
Длительные воспалительные процессы в лёгких при муковисцидозе способны приводить к амилоидозу – отложению защитных белков в клубочках почки (“почечных фильтрах”), способствуя прогрессированию недостаточности функции почек. Также постоянное воспаление характерно и для слизистой оболочки полости носа и придаточных пазух, что часто приводит к образованию доброкачественных опухолей – полипов.
Помимо лёгких и поджелудочной железы, в некоторых случаях происходит поражение печени, оно ассоциировано, преимущественно, с наличием мутаций в генах-модификаторах, обсуждаемых ранее. Развитие заболевание имеет схожий сценарий развития: повышенная вязкость выделяемого секрета клетками выводящих протоков препятствует выведению желчи в кишечник, способствуя воспалению желчных протоков, гибели печёночных клеток и постепенному формированию цирроза печени.
У мужчин с муковисцидозом наблюдается нарушенное развитие семявыносящих протоков, канальцев придатков яичка или полное закрытие их просвета за счёт разрастания соединительной ткани или нарушение развития, что в обоих случаях ведёт к бесплодию.
Диагностика
Муковисцидоз наследуется аутосомно-рецессивно; пол ребёнка не влияет на вероятность развития заболевания. При таком наследовании если у каждого из двух родителей имеется по одной болезнетворной мутации гена CFTR (носительство) в 25% случаев может родиться ребёнок с муковисцидозом. Заболевание диагностируется при наличии у пациента как минимум одного клинического проявления (поражение лёгких, поджелудочной железы, придаточных пазух носа, кишечника) и при подтверждении у него дисфункции хлоридного канала (выявление двух патогенных мутаций CFTR, положительный т.н. потовый тест).
В соответствии с Приказом Минздравсоцразвития РФ от 22.03.2006 N 185 "О массовом обследовании новорожденных детей на наследственные заболевания" в нашей стране проводится массовое выявление у новорожденных детей наиболее распространённых наследственных заболеваний, среди которых есть и муковисцидоз.
Лечение
Основные направления терапии у людей с муковисцидозом включают в себя:
1) повышение эффективности питания – приём пищеварительных ферментов и использование инсулина при развитии сахарного диабета;
2) улучшение вентиляции лёгких – использование препаратов расслабляющих мышцы бронхов и расширяющие их просвет, а также препаратов разжижающих слизь;
3) антибактериальная терапия инфекции лёгких, основная цель которой сохранить максимально возможный объём функционирующей легочной ткани.
Если замещение функции большей части поражаемых органов при муковисцидозе осуществимо, то компенсация функции дыхания на данный момент технически невозможна. Именно критическое поражение лёгких представляет наибольшую опасность для жизни человека с муковисцидозом. В таком случае единственно возможным решением остаётся трансплантация лёгких. Это опасная и рискованная операция. Объективным показанием для неё является снижение функции лёгких менее 30% от должного.
Наиболее эффективной медицинской помощью больным муковисцидозом оказалась таргетная терапия, направленная на коррекцию работы хлоридного канала. В 2012 году был зарегистрирован первый препарат с таким действием – ивакафтор (торговое название «калидеко»). Он всасывается в желудочно-кишечном тракте и распределяется по организму через системный кровоток. После чего попадает в клетки, где прикрепляется к белку хлоридного канала, способствуя повышению числа пропускаемых ионов хлора до нормальных значений. По итогам постоянного приёма препарата в поте пациентов снижается содержание соли ниже диагностически значимого уровня, а уровень функций лёгких по данным испытаний повышался на 17,2%.
Ивакафтор эффективен только при мутациях CFTR, не нарушающих встраивание белка в мембрану, т.е. при III-VI классах мутаций. Позже были разработаны лумакафтор, тезакафтор и элексакафтор – так называемые препараты-корректоры, обеспечивающие нормализацию транспорта белка хлоридного канала до мембраны клетки, помогая при II классе мутаций. Наибольшей эффективностью препараты-корректоры обладают при совместном использовании с ивакафтором, сейчас выпускается несколько таких комбинаций – оркамби, симдеко и трикафта. Недостатком таргетной терапии является необходимость принимать препараты каждые 12 часов и их огромная стоимость, терапия оркамби или трикафта достигает стоимости более 20 миллионов рублей в год. Но что наиболее важно, таргетная терапия не способна помочь людям с I классом мутаций. Но и для них ищутся новые подходы.
Генная терапия и редактирование генов
Описанные подходы направлены на коррекцию течения заболевания, но не на устранение его причины. Более технологичный подход, основанный на доставке в клетку необходимого гена, получил название генная терапия (рис. 3). Подобный принцип уже используется по всему миру, например, при вакцинации от коронавируса. Спутник V представляет собой безвредный вирус, который доставляет в клетку человека ген, с помощью которого производится белок коронавируса, вызывающий иммунизацию организма. В случае генной терапии муковисцидоза носители – векторы, которые могут быть как вирусными, так и невирусными, доставляют в нужные клетки работающий ген CFTR, на его основе создаётся белок (не вызывающий иммунного ответа, поскольку является родным для организма), формирующий канал в мембране и выполняющий функции переноса ионов хлора.
Как и обсуждалось ранее, лёгкие – основная цель для терапии, а следовательно, и основное место куда нужно доставить ген CFTR. Такая концепция способна помочь людям с мутациями любых классов, в том числе и когда белок не производится клетками.
Первые попытки разработки и применения генной терапии были осуществлены в 1993 году, но результаты не оправдали ожиданий. Сложности, с которыми столкнулась генная терапия заключаются в следующем: как вирусные, так и невирусные векторы могут вызывать воспаление лёгкого; проникновение вектора в клетки аэрозольным механизмом затруднено из-за наличия вязкой слизи, а при введении через системный кровоток вирусы случайным образом распределяются по организму и лишь в редких случаях достигают лёгких; клетки дыхательных путей постоянно обновляются и погибают — доставленные рабочие гены теряются вместе с ними; а также многие другие трудности. Некоторые из них решаются через использование дополнительных средств, например препаратов, разжижающих слизь, однако значительная часть проблем всё еще не решена.
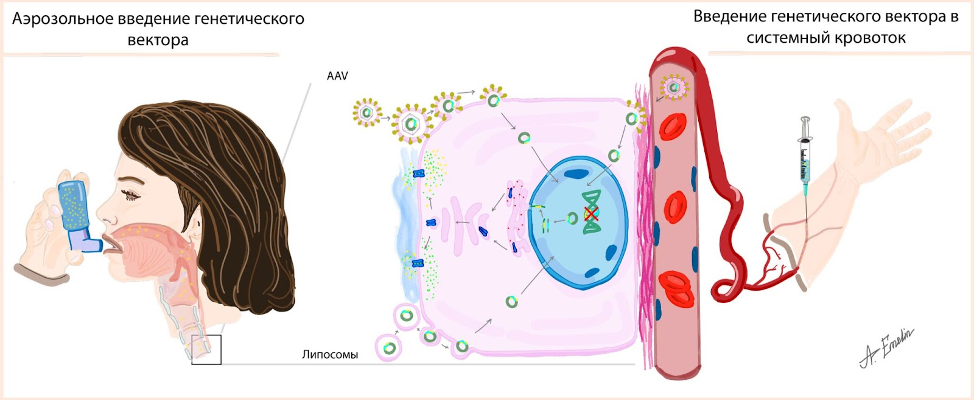
Попытки разработать препараты генной терапии не прекращаются и на сегодняшний день. В стадии доклинических исследований (до иследований на человеке) находится подход, основанный на доставке гена CFTR в клетки с помощью аденоассоциированного вируса. Терапевтический агент SP-101 (Spirovant, США) опробован на модельных животных – хорьках, с искусственно вызванной мутацией гена CFTR. Исследования показывают эффективность доставки и сохранённую функциональную активность гена (видео доклада можно посмотреть тут).
Альтернативный подход основан на доставке в клетки дыхательных путей матричной РНК (мРНК) гена CFTR. мРНК представляет собой компонент промежуточного этапа образования хлоридного канала, именно с мРНК происходит считывание и сборка аминокислотной последовательности работающего белка.
Терапевтический агент LUNAR®-CF (Arcturus Therapeutics, США) — мРНК CFTR помещённая в липидную наночастицу, также проходит этап доклинических исследований, опробован на нескольких видах модельных животных с мутацией и на нечеловекообразных обезьянах для оценки эффективности этого метода доставки генетического материала (тут можно посмотреть постер доклада).
Основным приложением разрабатываемой генной терапии рассматриваются варианты мутации I и II класса, при которых оказывается неэффективно использование таргетной терапии ивакафтором и корректорами хлоридного канала. Ещё одно направление терапии, цель которой исправить работу гена, основывается на редактировании его структуры. При данном подходе в клетку доставляются молекулярные инструменты, исправляющие повреждённый участок гена. Один из таких препаратов, разрабатываемый компанией SalioGen (США), также находится в фазе доклинических исследований.
Где искать помощь?
Трудоспособность людей с муковисцидозом значительно снижена из-за тяжести заболевания, а современное лечение является дорогостоящей процедурой. На территории Российской Федерации действует несколько фондов, оказывающих финансовую, социальную, юридическую помощь и психологическую поддержку пациентам с муковисцидозом, среди них: ● Благотворительный фонд “Кислород” ● Благотворительный фонд “Острова” ● Благотворительный фонд “Во имя жизни”
Текст: Алексей Емелин