Сотрудники факультета фундаментальной медицины МГУ имени М.В. Ломоносова разработали способ быстро выделять ядра клеток млекопитающих, что позволило уточнить механизмы гибели клеток при лечении противораковым препаратом цисплатином. Исследование было поддержано грантом Президентской программы исследовательских проектов Российского научного фонда (РНФ). Результаты работы опубликованы в журнале Scientific Reports.
Карцинома – злокачественная опухоль, которая развивается из клеток кожи, слизистых оболочек и многих внутренних органов. Раковые клетки могут быстро перемещаться в организме (с током лимфы и крови) и образовывать новые очаги опухоли. Широко известный препарат цисплатин содержит тяжелый металл, платину, который связывается с ДНК и нарушает ее функции. Такое воздействие препятствует делению клетки и приводит к ее гибели. Помимо раковых клеток, страдают другие активно делящиеся клетки: слизистых оболочек, крови, костного мозга, половых желез. Изучая механизм программируемой гибели клеток, который запускается подобными препаратами, медики постепенно повышают эффективность противоопухолевой терапии.
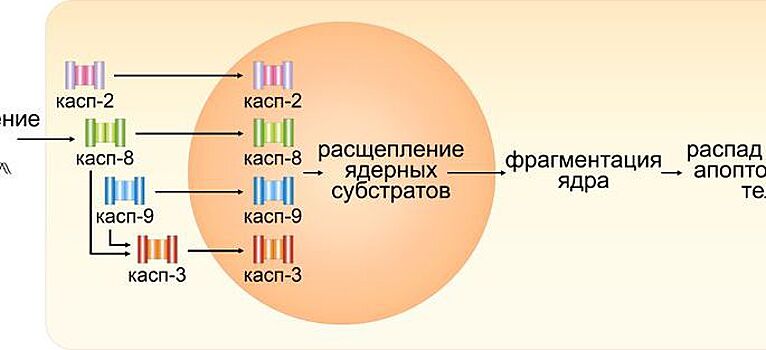
Сотрудницы факультета фундаментальной медицины МГУ Евгения Прохорова и Гелина Копеина разработали уникальную методику выделения ядер из клеток человека. Ученые исследовали активность каспаз (ферментов, расщепляющих белки и способствующих успешному протеканию апоптоза, одного из механизмов программируемой гибели клеток) и их роль в ядре клеток при апоптозе. Разработанная методика подходит для любых клеток млекопитающих. Ученые доказали ее эффективность, наблюдая процесс с помощью особо точного микроскопа (конфокальной флуоресцентной микроскопии) и метода, позволяющего определить специфичные белки (вестерн-блот-анализа).
"В ходе работы мы показали, что химиотерапевтический препарат цисплатин запускает переход каспаз из цитоплазмы в ядро в клетках карциномы яичника, карциномы шейки матки и рака груди. При воздействии цисплатина на раковые клетки происходит массовое повреждение ДНК, что приводит к активации специальных ферментов – инициаторных каспаз-2, -8 и -9", – рассказал заведующий лабораторией исследования механизмов апоптоза МГУ, доктор биологических наук Борис Животовский.
Вестерн-блот-анализ, измерение активности ферментов и флуоресцентная микроскопия помогли доказать, что во время программируемой гибели клетки сразу четыре вида каспаз (эффекторная каспаза-3 и инициаторные -2, -8 и -9) одновременно перемещаются в неразрушенное ядро и ускоряют его распад.
Видимо, описанный механизм требуется клетке для ускорения программируемой гибели. Содержимое ядер (ДНК, РНК, белки) при попадании в окружающие ткани может стать иммуногенным фактором, то есть вызвать реакцию иммунитета, как на чужеродные объекты. Иммунный ответ, в свою очередь, может привести к воспалению ткани. Кроме того, "опасный" генетический материал, находящийся в ядре, может перенести информацию в другие клетки и ткани, поэтому уничтожить ядро во время апоптоза "аккуратным" образом, в том числе с помощью каспаз, очень важно для поддержания нормальной работы тканей. Этот процесс играет значимую роль не только в гибели клеток, которые были обработаны ДНК-повреждающими агентами, но и при стимуляции так называемых рецепторов смерти – рецепторов на клеточной мембране, запускающих апоптоз по сигналу снаружи.
"Обнаружение новых процессов в механизме программируемой гибели клеток расширяет горизонты знаний о действии химиотерапевтических препаратов на опухолевые клетки и позволяет увеличить эффективность существующего противоопухолевого лечения. Более того, обнаруженный механизм подчеркивает важность "аккуратного" распада ядра в условиях апоптоза, чтобы "вредное" содержимое ядра не попало в окружающие ткани", – пояснил ученый.